
Marion Ravelojaona, doctorante en biologie cellulaire et moléculaire. Photo: Isabelle Cardinal
Cet article – Courant d’idées – est rédigé par Marion Ravelojaona, doctorante en biologie cellulaire et moléculaire et chercheuse au Laboratoire de recherche en immunologie et oncologie de l’Université du Québec à Trois-Rivières (UQTR).
L’inflammation intra-utérine : ami ou ennemi ?
Pendant la grossesse, le système immunitaire intra-utérin assure la protection et la défense du fœtus contre les pathogènes tout en contribuant activement à son développement. Cette contribution passe par l’orchestration d’une communication coordonnée et synchronisée entre les différents types cellulaires de l’interface fœto-maternelle grâce à la production et la sécrétion de molécules immunologiques appelées : cytokines, chimiokines ou facteurs de croissances. Un dysfonctionnement de l’activité immunologique à l’interface fœto-maternelle entraîne des complications de grossesse telles que des fausses couches répétées, des naissances prématurées, des retards de développement fœtal ou encore la prééclampsie.
Plusieurs études rapportent que l’origine de ce dysfonctionnement immunologique réside dans l’activité incontrôlée de cytokines pro-inflammatoires telles que l’interféron gamma (IFNγ), le facteur de stimulation des colonies de granulocytes et de macrophages (GM-CSF) ou encore le facteur de nécrose tumoral (TNF) dans l’utérus maternel.
En effet, dans une grossesse normale, ces molécules pro-inflammatoires sont présentes et utiles à la grossesse, notamment durant le premier trimestre de grossesse. Cependant, leur activité inflammatoire est finement contrôlée par l’intervention de cytokines ou de facteurs anti-inflammatoires. L’intervention de ces molécules anti-inflammatoires est essentielle dans l’établissement et le maintien de l’immunotolérance maternelle envers le fœtus, empêchant ainsi le rejet de ce dernier, considéré comme un corps étranger par le système immunitaire maternel (Mor, Aldo et al. 2017). Ainsi, la tolérance immunologique et la régulation de l’inflammation intra-utérine sont fondamentales pour le succès de la grossesse.
L’Oncostatine M, gardienne discrète de l’interface fœto-maternelle
De ce rôle de gardiens de l’immunotolérance, plusieurs études ont identifié et décrit différentes molécules, cependant aucune étude ne s’est réellement penchée sur le rôle et l’effet de l’Oncostatine M (OSM) dans ce contexte bien qu’elle soit présente à l’interface fœto-maternelle et qu’elle participe à l’implantation embryonnaire. Ainsi, nos études se sont intéressées à cette cytokine en tant que régulatrice de l’inflammation intra-utérine.
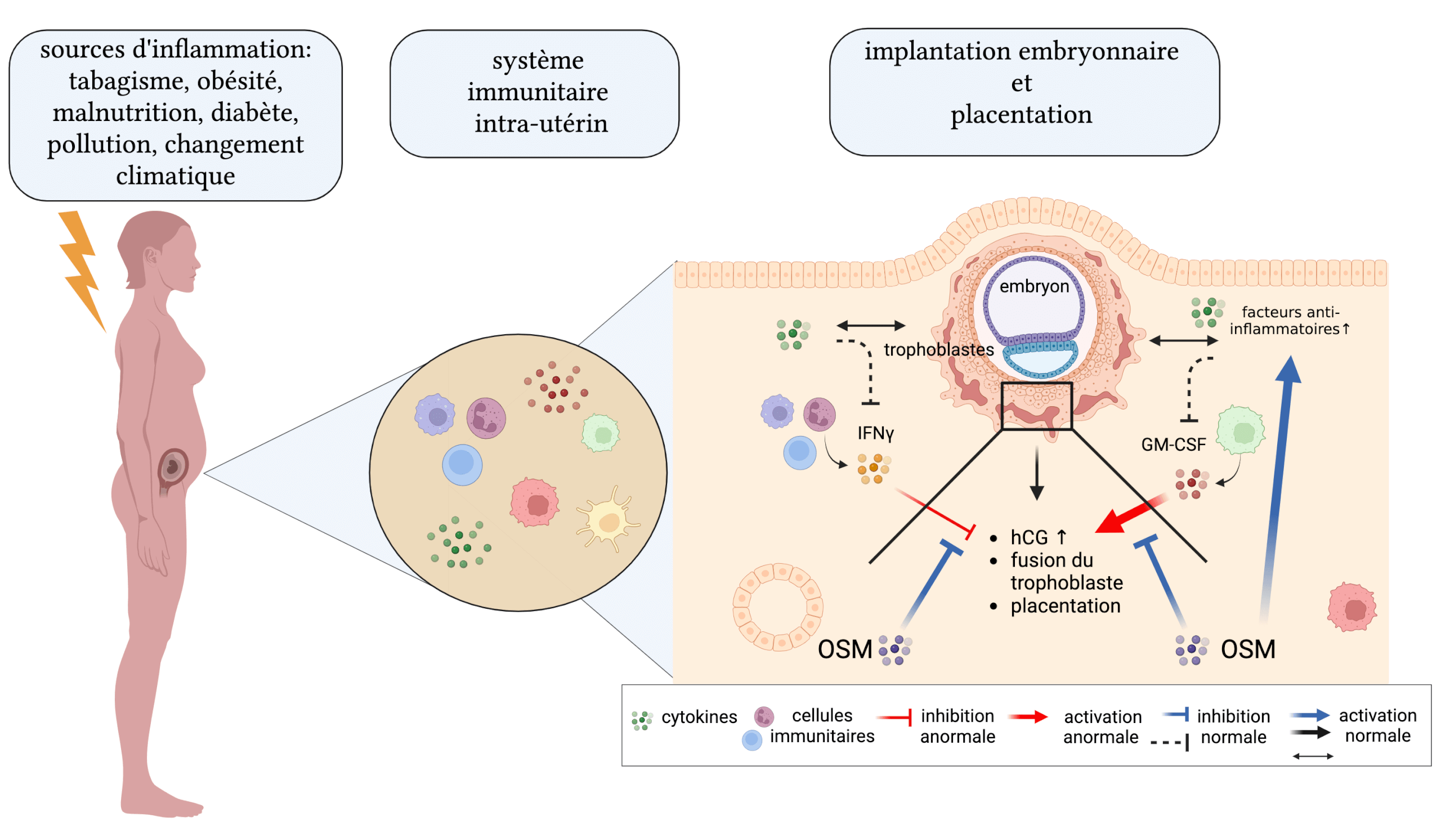
Effets régulateurs de l’Oncostatine M (OSM) sur l’activité anormale des facteurs pro-inflammatoires IFNγ et GM-CSF durant l’implantation embryonnaire et la placentation dans les cellules humaines de placenta.
Dans un premier temps, nous avons démontré l’effet néfaste de l’inflammation au travers de l’activité incontrôlée des cytokines pro-inflammatoires IFNγ et du GM-CSF. Nos études montrent que ces molécules induisent des productions anormales de la gonadotrophine chorionique humaine (hCG), aussi appelée hormone de grossesse, dans des cellules humaines de placenta. Il faut savoir que l’hormone hCG est impliquée dans l’implantation embryonnaire et la formation du placenta. C’est pourquoi l’ajustement de sa production est important dans le succès de la grossesse. Ainsi, cette première partie de l’étude a fait le lien avec des recherches qui ont démontré qu’une concentration anormalement élevée ou faible de hCG serait à l’origine de troubles développementaux chez le fœtus ou pourrait engendrer l’apparition de choriocarcinome chez la mère (Nwabuobi, Arlier et al. 2017).
De manière très intéressante, nos travaux ont démontré ensuite que l’OSM est capable de contrôler l’activité inflammatoire de l’IFNγ et du GM-CSF dans les cellules humaines de placenta, préservant ainsi une production normale de hCG. Ainsi, l’ensemble de nos résultats démontrent pour la première fois que l’OSM était capable de « réparer » les dysfonctionnements induits par les molécules pro-inflammatoires et maintenir une production normale de hCG.
De plus, nous avons démontré les propriétés anti-inflammatoires de l’OSM dans les cellules humaines de placenta, pouvant contribuer grandement à l’immunotolérance à l’interface fœto-maternelle par la stimulation d’un ensemble de molécules anti-inflammatoires (Ravelojaona, Girouard et al. 2024).
Nos études actuelles visent à démontrer si les effets anti-inflammatoire et homéostatique de l’OSM se produisent aussi dans l’utérus maternel, préservant ainsi la capacité d’implantation embryonnaire et de formation du placenta au cours de la gestation chez un modèle animal en situation de stress inflammatoire.
L’ensemble de ces découvertes ouvrent de nouvelles portes quant à la compréhension des fonctions de l’OSM à l’interface fœto-maternelle, mais présente également de nouvelles perspectives thérapeutiques, préventives ou de diagnostic face aux complications de la grossesse ou aux problèmes de fertilité liés à l’inflammation intra-utérine.

L’équipe du Laboratoire de recherche en immunologie et oncologie dirigée par le professeur Carlos Reyes-Moreno (à l’extrême droite sur la photo). On aperçoit également, de gauche à droite: Farhan Heydari, Nihad Khiat, Emmanuelle Stella Kana Tsapi, Julie Girouard, Laurie Fortin et Marion Ravelojaona.
Consultez l’article original paru dans Cells : Oncostatin M and STAT3 Signaling Pathways Support Human Trophoblast Differentiation by Inhibiting Inflammatory Stress in Response to IFN? and GM-CSF
Références
Mor, G., P. Aldo and A. B. Alvero (2017). « The unique immunological and microbial aspects of pregnancy. » Nat Rev Immunol 17(8): 469-482.
Nwabuobi, C., S. Arlier, F. Schatz, O. Guzeloglu-Kayisli, C. J. Lockwood and U. A. Kayisli (2017). « hCG: Biological Functions and Clinical Applications. » Int J Mol Sci 18(10).
Ravelojaona, M., J. Girouard, E. S. Kana Tsapi, M. Chambers, C. Vaillancourt, C. Van Themsche, C. A. Thornton and C. Reyes-Moreno (2024). « Oncostatin M and STAT3 Signaling Pathways Support Human Trophoblast Differentiation by Inhibiting Inflammatory Stress in Response to IFNgamma and GM-CSF. » Cells 13(3).



