Cet article – Courant d’idées – est rédigé par Charles Gagnon, étudiant à la maîtrise en sciences de l’environnement (profil avec mémoire) de l’Université du Québec à Trois-Rivières (UQTR).

Charles Gagnon, étudiant à la maîtrise en sciences de l’environnement (profil avec mémoire) de l’UQTR.
Pour une grande quantité d’insectes à travers le monde, ce scénario d’horreur n’a rien de fictif. Ce monstre existe bel et bien, mais rassurez-vous, c’est un parasite des arthropodes. Vous ne faites donc pas partie des hôtes potentiels. Son nom ? « Le cheveu de cheval », un ver nématomorphe (phylum : Nematomorpha) capable de manipuler le comportement de son hôte jusqu’à le pousser à une mort de noyade. À première vue, cet organisme pourrait sembler n’être qu’un symbole de dégoût et de cruauté biologique. Et pourtant… détrompez-vous ! Derrière son apparence sinistre se cache un être aux fonctions écologiques inattendues qui pousse à repenser l’idée que les cours d’eau et les forêts fonctionnent indépendamment, alors qu’ils sont en réalité étroitement connectés.

Plusieurs nématomorphes (Chododes fomosanus) s’extirpant d’une mante géante asiatique (Hierodula patellifera). (Hung, 2018)

Plusieurs nématomorphes (Chododes fomosanus) s’extirpant d’une mante géante asiatique (Hierodula patellifera). (Hung, 2018)
Un cycle de vie complexe
Souvent invisibles et négligés, les parasites jouent un rôle essentiel dans le fonctionnement des écosystèmes, bien au-delà de ce que l’on peut imaginer. Les parasites nématomorphes sont un bon exemple d’organismes exerçant une influence écologique insoupçonnée — une influence rendue possible en partie par la complexité de leur cycle de vie. Ce cycle de vie alterne entre un stade larvaire parasitaire et un stade adulte libre. Pour se reproduire, les adultes doivent impérativement rejoindre un milieu aquatique, où ils trouvent un partenaire sexuel. Ils y parviennent en manipulant le comportement de leur hôte terrestre et en le forçant à se jeter dans l’eau via des mécanismes encore peu connus. Une fois immergé, le parasite s’extirpe spectaculairement de l’exosquelette de son hôte et l’insecte parasité attire parfois l’attention des prédateurs aquatiques comme des poissons en se débattant à la surface.
Ce transfert de biomasse entre les deux milieux (aquatique et terrestre) orchestré par le parasite représente donc une source d’énergie pour les communautés aquatiques. En effet, les insectes terrestres manipulés par les nématomorphes peuvent constituer jusqu’à 60 % de l’apport énergétique annuel des salmonidés dans certains cours d’eau. Ce phénomène, où la biomasse produite dans un type d’écosystème est consommée dans un autre sous l’effet d’une manipulation parasitaire, illustre un flux d’énergie médié par la manipulation parasitaire. Les nématomorphes ne se contentent donc pas d’exploiter leur hôte pour survivre : ils redirigent le flux d’énergie des écosystèmes terrestres vers les milieux aquatiques. Puisqu’ils sont largement répandus dans le monde et leurs hôtes terrestres très abondants, il est probable que ce transfert inter-écosystémique soit un phénomène encore sous-estimé.
Effet domino écologique
Les conséquences de ce flux de matière sont bien plus grandes ; elles ne se limitent pas à constituer la diète des poissons. En effet, cela peut engendrer ce qu’on appelle une cascade trophique à effet descendant (« top-down »). Dans un écosystème, chaque niveau de la chaîne alimentaire influence le suivant et un changement dans la population des prédateurs peut causer des répercussions sur les organismes situés plus bas dans la chaîne. Dans ce contexte, l’afflux d’insectes terrestres permet de saturer l’alimentation des poissons, relâchant la pression de prédation sur les invertébrés benthiques (organismes vivant au fond des cours d’eau). Ainsi, ces derniers peuvent prospérer, se nourrir, croître et exercer une pression plus forte sur leurs propres ressources. Parmi eux, certains sont herbivores, se nourrissant d’algues, tandis que d’autres, appelés détritivores, décomposent feuilles mortes et matière organique. Une augmentation de l’abondance de ces deux groupes d’alimentation peut engendrer respectivement une réduction de la quantité d’algues et une accélération du taux de décomposition des matières organiques (voir schéma). Par conséquent, un simple changement en haut de la chaîne alimentaire se répercute jusqu’à la base de l’écosystème — c’est le principe de l’effet « top-down ». Une cascade d’effets écologiques déclenchée, en dernière instance, par un cycle de vie parasitaire complexe qui nécessite un vecteur de transport pour rejoindre son lieu de reproduction. Ce phénomène met finalement en lumière l’interaction entre les écosystèmes et nous invite à les repenser comme des milieux interdépendants plutôt que des entités isolées.
Petits organismes essentiels
Les parasites passent la majeure partie de leur existence en contact étroit avec leurs hôtes et sont souvent invisibles aux yeux du reste du monde. Il serait alors facile de supposer que, parce qu’ils sont peu visibles, leurs impacts écologiques sont secondaires par rapport à celui des organismes libres. Cependant, les recherches montrent que les parasites peuvent jouer un rôle tout aussi déterminant, voire parfois supérieur, dans la structuration des communautés. Le parasitisme constitue l’une des stratégies de vie les plus répandues dans le monde vivant. Le reconnaître comme une force écologique à part entière n’a rien d’un exercice théorique : c’est une condition essentielle pour comprendre le fonctionnement des écosystèmes. C’est dans cette perspective que la Chaire de recherche du Canada sur les échanges entre les écosystèmes, dirigée par le professeur Éric Harvey (Département des sciences de l’environnement, UQTR), tentera d’intégrer les dimensions parasitaires dans ses axes de recherche. De nouveaux projets sont en cours de développement au sein du laboratoire afin d’explorer plus en profondeur le rôle des parasites dans la structuration des communautés et des flux d’énergie à l’échelle des paysages.
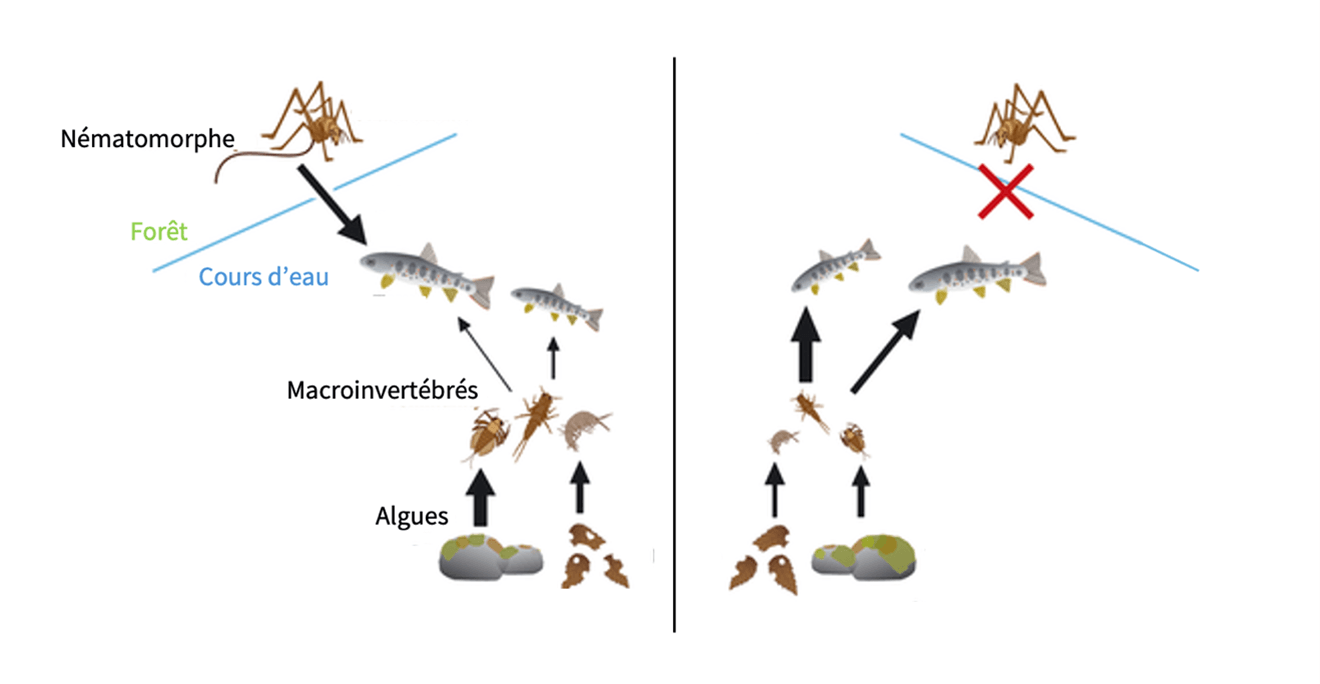
Schéma récapitulatif de la comparaison des interactions alimentaires entre la présence et l’absence de nématomorphe. Les flèches noires indiquent des relations de consommation directe; l’épaisseur des flèches représente l’intensité de chaque interaction. (Sato et al., 2011)
Bibliographie
De Meeûs, T. & Renaud, F. (2002). Parasites within the new phylogeny of eukaryotes. Trends in Parasitology, 18(6), 247-251.
Hanelt, B., Thomas, F. & Schmidt-Rhaesa, A. (2005). Biology of the phylum Nematomorpha, Advances in Parasitology, 59, 243–305.
Hung, K.-C. (2018). Observation iNaturalist de Chordodes formosanus dans le comté de Miaoli, Taïwan. https://www.inaturalist.org/observations/14567767
Poinar, G. (2008). Global diversity of hairworms (Nematomorpha: Gordiaceae) in freshwater, Hydrobiologia, 595, 79–83.
Price, P. W., Westoby, M., Rice, B., Atsatt, P. R., Fritz, R. S., Thompson, J. N. & Mobley, K. (1986). Parasite Mediation in Ecological Interactions, Annual Review of Ecology and Systematics, 17, 487-505 .
Sato, T., Egusa, T., Fukushima K., Oda, T., Ohte, N., Tokushi, N., Watanabe, K., Kanaiwa, M., Murakami, I. & Lafferty, K. (2012). Nematomorph parasites indirectly alter food web and ecosystem function of streams through behavioural manipulation of their cricket hosts, Ecology Letters, 15(8), 786-793.
Sato, T., Watanabe, K., Kanaiwa, M., Niizuma, Y., Harada, Y. & Lafferty, K. (2011). Nematomorph parasites drive energy flow through a riparian ecosystem, Ecology, 92(1), 201–207.
Courant d’idées permet à la communauté scientifique de l’UQTR de s’exprimer sur différents sujets et enjeux à travers une série d’articles vulgarisés pour le grand public. Consultez notre guide de rédaction.
Ouvert aux chercheurs, étudiants de cycles supérieurs et chargés de cours.



